9.5 Porušení Octet Pravidlo
Cíl Učení
- Rozpoznat tři hlavní typy porušení octet pravidlo.
Jak důležité a užitečné je pravidlo oktetu v chemické vazbě, existují některá známá porušení. To neznamená, že pravidlo oktetu je zbytečné-právě naopak— Stejně jako u mnoha pravidel existují výjimky nebo porušení.
existují tři porušení pravidla oktetu. Odd-elektronové molekulymolekula s lichým počtem elektronů ve valenčním plášti atomu. představují první porušení pravidla oktetu. I když je jich málo, některé stabilní sloučeniny mají ve svých valenčních skořápkách lichý počet elektronů. S lichým počtem elektronů bude muset alespoň jeden atom v molekule porušit pravidlo oktetu. Příklady stabilních molekul lichých elektronů jsou NO, NO2 a ClO2. Lewis elektron dot diagram pro NE je následující:
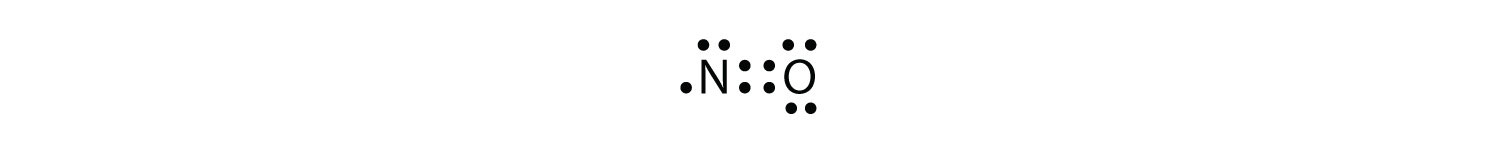
i když O atom má oktet elektronů, N atom má pouze sedm elektronů ve své valenční. Ačkoli NO je stabilní sloučenina, je velmi chemicky reaktivní, stejně jako většina ostatních lichých elektronových sloučenin.
molekuly s nedostatkem Elektronůmolekula s méně než osmi elektrony ve valenčním plášti atomu. představují druhé porušení pravidla oktetu. Tyto stabilní sloučeniny mají méně než osm elektronů kolem atomu v molekule. Nejběžnějšími příklady jsou kovalentní sloučeniny berylia a boru. Například berylium může tvořit dvě kovalentní vazby, což má za následek pouze čtyři elektrony ve své valenční skořápce:
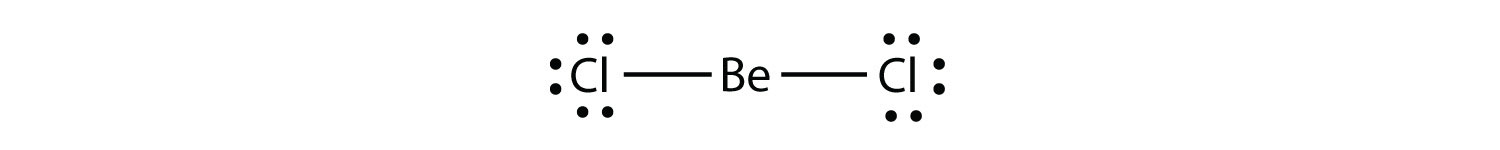
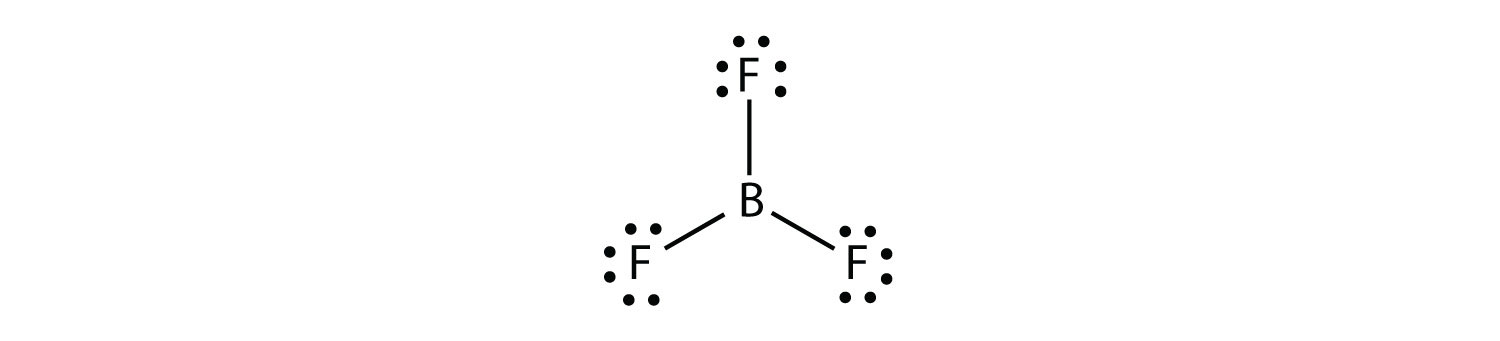
Bor běžně dělá pouze tři kovalentní vazby, což vede jen šest valenčních elektronů kolem B atom. Dobře známý příklad je BF3:
třetí porušení octet pravidlo je nalézt v těch sloučenin, s více než osmi elektrony přiřazeny k jejich valence shell. Ty se nazývají rozšířené molekuly valenční skořepinymolekula s více než osmi elektrony ve valenčním plášti atomu.. Tyto sloučeniny jsou tvořeny pouze centrální atomy ve třetí řadě periodické tabulky, nebo mimo ni, které mají prázdnými d-orbitaly v jejich valenční mušlí, které se mohou podílet na kovalentní vazby. Jednou takovou sloučeninou je PF5. Jediné rozumné Lewis elektron dot diagram pro tato sloučenina má P atom pěti kovalentní vazby.
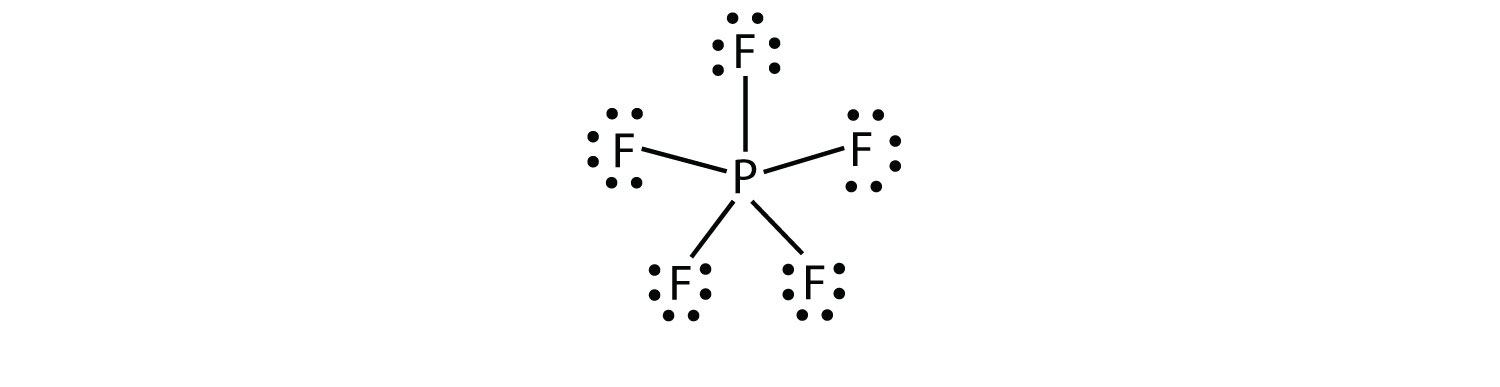
Oficiálně, P atom má 10 elektronů ve své valenční.
Příklad 9
Identifikovat každé porušení octet pravidlo kreslení Lewis elektron dot diagram.
- ClO
- SF6
Řešení
-
S jedním Cl atom a jednou O atom, tato molekula má 6 + 7 = 13 valenční elektrony, tak to je liché-elektronové molekuly. Lewis elektron dot diagram pro tuto molekulu je následující:

-
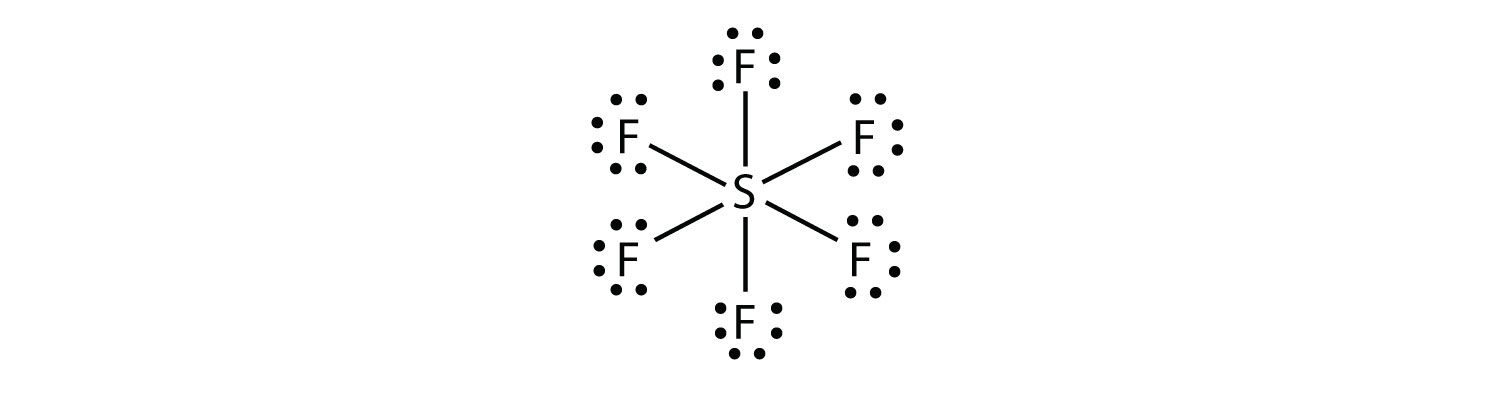
V SF6, S centrální atom je šest kovalentní vazby pro šest okolních F atomů, takže je rozšířené valenční molekuly. Jeho Lewisův elektronový bodový diagram je následující:
Otestujte Sami sebe,
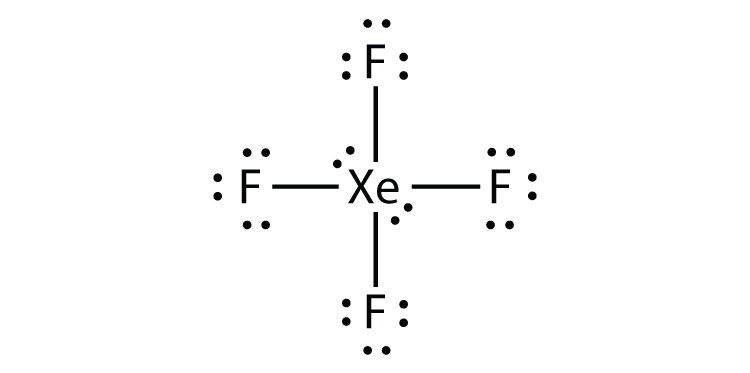
Identifikovat porušení octet pravidlo v XeF2 kreslení Lewis elektron dot diagram.
odpověď
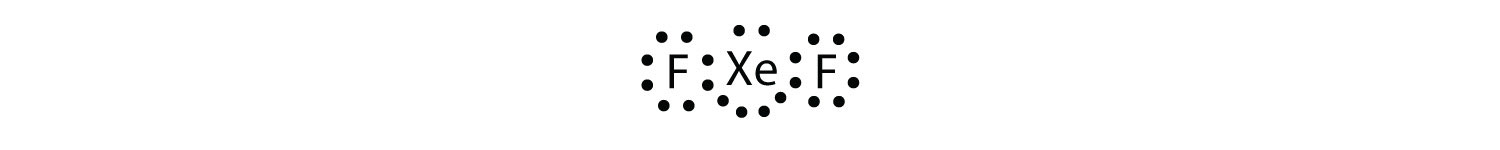
atom Xe má rozšířenou valenční skořápku s více než osmi elektrony kolem něj.
Key Stánek s jídlem
- Existují tři porušení octet pravidlo: liché-elektronové molekuly, elektron-deficitní molekuly a rozšířené valenční molekuly.
cvičení
-
proč molekula lichého elektronu nesplňuje pravidlo oktetu?
-
proč atom ve druhém řádku periodické tabulky netvoří rozšířené molekuly valenční skořápky?
-
Nakreslit přijatelnou Lewis elektron dot diagram pro tyto molekuly, které porušují octet pravidlo.
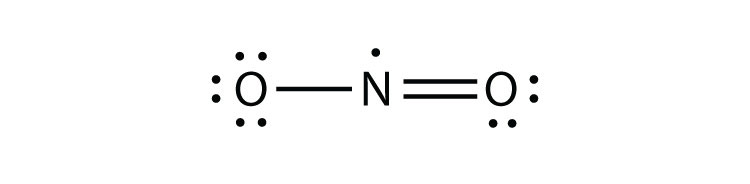
- NO2
- XeF4
-
Nakreslit přijatelnou Lewis elektron dot diagram pro tyto molekuly, které porušují octet pravidlo.
- BCl3
- ClO2
-
Nakreslit přijatelnou Lewis elektron dot diagram pro tyto molekuly, které porušují octet pravidlo.
- POF3
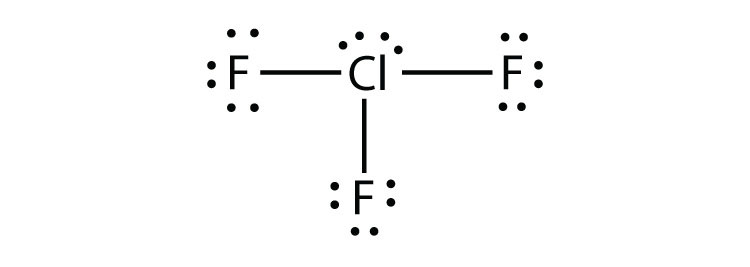
- ClF3
-
Nakreslit přijatelnou Lewis elektron dot diagram pro tyto molekuly, které porušují octet pravidlo.
- SF4
- BeH2
odpovědi
-
není možné spárovat všechny elektrony, pokud je jich lichý počet.
-
-
-
-