Jak víte, Dmitri Mendeleev je otcem periodické tabulky. Ale věděli jste, že moderní Periodická tabulka, kterou používáme, byla ve skutečnosti vyvinuta vědcem jménem Henry Moseley? Naučme se fascinující historii za periodickou tabulkou.
Suggested Videos
Moderní Periodické Tabulky
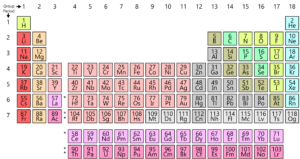
Jak víte, všechny prvky na zemi jsou uspořádány v mřížce nebo matice s názvem Moderní Periodické Tabulky. Uspořádání těchto prvků je podle vzoru. Periodická tabulka byla skutečně vyvinuta a Mendeleev na počátku 1800. Ve skutečnosti to však zdokonalil Henry Moseley, anglický fyzik v roce 1913. Tím, že upravil periodický zákon, zlepšil všechny nedostatky Mendeleevovy tabulky. Podívejme se na tento vývoj.
Procházet více Témat v rámci Periodická Klasifikace Prvků
- Dříve Pokusy o Klasifikaci Prvků
- Poloha Prvků v Moderní Periodické Tabulky
- Trendy v Moderní Periodické Tabulky
Použití Atomové Číslo
za Prvé, pojďme se podívat na atomovou strukturu. Každý atom je tvořen jádrem, které se skládá z protonů a neutronů. Zde mají protony kladný náboj a neutron nemá žádný náboj. Nyní elektrony (nesoucí záporný náboj) obklopují jádro. Nyní je atomové hmotnostní číslo celkovým počtem protonů a neutronů v atomu. A atomové číslo je počet protonů v atomu. Toto atomové číslo je zcela jedinečné pro každý prvek, což znamená, že každý prvek na planetě má své vlastní jedinečné atomové číslo.
byl to Henry Moseley, kdo navrhl lepší uspořádání než Mendělejev. Uspořádal prvky podle jejich atomového čísla spíše než podle jejich atomové hmotnosti. Tím se zlepšil oproti předchozí tabulce a odstranil některé její obtíže a anomálie.
Poloha vodíku
Mendeleev nikdy nedokázal zjistit správnou polohu vodíku ve své tabulce. Protože vodík může buď získat nebo ztratit elektron, může najít místo ve skupině 1 nebo 17. Jeho elektronická konfigurace se podobá konfiguraci alkalických kovů. I když se může také kombinovat s kovy a nekovy tvořícími kovalentní vazby, jako jsou halogeny.
ale v moderní periodické tabulce neexistuje žádné dilema. Vzhledem k tomu, že atomové číslo vodíku je 1, je to místo, kde najde své vhodné místo na začátku tabulky.
Izotopy
Izotopy jsou různé atomy prvku z nichž každá má stejný počet protonů, ale různý počet neutronů v jejich jádra. To znamená, že i když se jejich atomová hmotnost liší, jejich atomové číslo je stejné. Jako například uhlík-14 je radioaktivní izotop atomu uhlíku, který má osm neutronů.
zatímco to představovalo problém pro Mendělejeva, protože tabulka závisela na atomové hmotnosti, není to problém s moderní periodickou tabulkou. Všechny izotopy prvků nemají na stole samostatná místa.
pořadí určitých prvků
Mendeleev při použití atomové hmoty k uspořádání prvků čelil jinému problému. Byly určité případy, kdy došlo k porušení tohoto uspořádání, takže prvky s podobnými vlastnostmi byly ve skupině dohromady. Vezměme si příklad jódu a teluru. Nyní je atomová hmotnost jodu nižší než telur. A přesto to Mendělejev dal po teluru, aby mohl být ve stejné skupině jako fluor a chlor.
v moderní periodické tabulce se atomová hmotnost stává irelevantní a prvky jsou seskupeny s podobnými prvky na základě jejich atomového čísla.
Prvky Vzácných Zemin
moderní periodické tabulky vyřešen i další problém, tím, že prvky vzácných zemin jako je Ceru, Lanthanu, Erbium atd v samostatné tabulce v dolní části Periodické tabulky, aby nedošlo k rozporu s Periodický Zákon.
vyřešeno příklad pro vás
Q: Ze všech 118 známých prvků, kolik prvků se přirozeně vyskytuje?