Klíčové Vlastnosti
ujistěte Se, že můžete definovat a používat v kontextu, základní pojmy níže.
- Adamsův katalyzátor
- hydrogenace
Studijní Poznámky
Chemické reakce, které jsou heterogenní mít reaktantů, které jsou v alespoň dvou různých fází (např. plyn, pevná látka), vzhledem k tomu, homogenní reakce probíhají v jedné fázi (např. plyn s jiným plynem).
může vzniknout určitý zmatek z popisu katalyzátoru použitého při reakci mezi alkeny a vodíkem. Tři kovy—nikl, platina a palladium—jsou běžně používané, ale chemik nemůže jednoduše umístěte kousek jednoho z těchto kovů ve směsi z alken a vodíku a reakce. Každý kovový katalyzátor musí být připraven zvláštním způsobem:
- nikl se obvykle používá v jemně rozdělené formě zvané “ Raney nikl.“Připravuje se reakcí slitiny Ni-Al s NaOH.
- palladium se získává komerčně „podporováno“ na inertní látce, jako je uhlí, (Pd/C). Alken se obvykle rozpustí v ethanolu, když se jako katalyzátor použije Pd/c.
- platina se používá jako PtO2, Adamsův katalyzátor, i když je to vlastně platinový kov, který je katalyzátorem. Vodík použitý k přidání do dvojné vazby uhlík-uhlík také redukuje oxid platiny (IV) na jemně dělený platinový kov. Jako rozpouštědlo pro Alken se používá Ethanol nebo kyselina octová.
jiné typy sloučenin obsahujících více vazeb, jako jsou ketony, estery a nitrily, nereagují s vodíkem za podmínek používaných k hydrogenaci alkenů. Níže uvedené příklady ukazují redukci alkenu, ale přítomné ketonové a nitrilové skupiny zůstávají neporušené a nejsou redukovány.

Aromatické kruhy jsou také není snížena za podmínek používá ke snížení alkenů, i když tyto kruhy se objevují obsahují tři uhlík-uhlík dvojné vazby. Jak uvidíte později, aromatické kroužky nemají opravdu obsahovat žádné dvojné vazby, a mnoho lékárny raději představují benzenový kruh jako šestiúhelník s kruhem uvnitř,

spíše než jako šestiúhelník se třemi střídající se dvojné vazby.
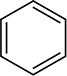
reprezentace benzenového kruhu bude dále diskutována v oddíle 15.2.
reakce mezi dvojnými vazbami uhlík-uhlík a vodíkem poskytuje způsob stanovení počtu dvojných vazeb přítomných ve sloučenině. Například jeden mol cyclohexene reaguje jeden mol vodíku vyrábět jeden mol cyklohexanu:

ale jeden mol 1,4-cyclohexadiene reaguje se dvěma moly vodíku tvoří jeden mol cyklohexanu:
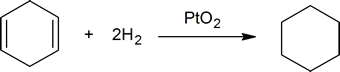
chemik by řekl, že cyclohexene reaguje s jeden ekvivalent vodíku, a 1,4-cyclohexadiene reaguje s dvěma ekvivalenty vodíku. Pokud vezmete známé množství neznámého nenasyceného uhlovodíku a určíte, kolik vodíku absorbuje, můžete snadno určit počet dvojných vazeb přítomných v uhlovodíku (viz otázka 2 níže).
přidání vodíku k dvojné vazbě uhlík-uhlík se nazývá hydrogenace. Celkovým účinkem takového přidání je redukční odstranění funkční skupiny dvojných vazeb. Regioselektivita není problém, protože stejná skupina (atom vodíku) je vázána na každý z dvojných vazebných uhlíků. Nejjednodušším zdrojem dvou atomů vodíku je molekulární vodík (H2), ale smíchání alkenů s vodíkem nevede k žádné rozpoznatelné reakci. I když celkový hydrogenační reakce je exotermní, vysoká aktivační energie brání probíhá za normálních podmínek. Toto omezení může být obcházeno použitím katalyzátoru, jak je znázorněno na následujícím diagramu.
příklad z alken kromě reakce je proces zvaný hydrogenace.V hydrogenační reakce, dva atomy vodíku jsou přidány přes dvojitou vazbou to alken, což má za následek nasycený alkan. Hydrogenace dvojné vazby je termodynamicky příznivá reakce, protože tvoří stabilnější (nižší energetický) produkt. Jinými slovy, energie produktu je nižší než energie reaktantu; je tedy exotermní (uvolňuje se teplo). Uvolněné teplo se nazývá teplo hydrogenace, což je indikátor stability molekuly.


Katalyzátory jsou látky, které mění rychlost (rychlosti) chemické reakce, aniž by byl spotřebován, nebo se objevuje jako součást produktu. Katalyzátory působí snížením aktivační energie reakcí, ale nemění relativní potenciální energii reaktantů a produktů. Jemně rozdělené kovy, jako je platina, palladium a nikl, patří mezi nejpoužívanější hydrogenační katalyzátory. Katalytická hydrogenace probíhá nejméně ve dvou fázích, jak je znázorněno na obrázku. Nejprve musí být Alken adsorbován na povrchu katalyzátoru spolu s částí vodíku. Dále se dva vodíky přesouvají z povrchu kovu na uhlíky dvojné vazby a výsledný nasycený uhlovodík, který je slabě adsorbován, opouští povrch katalyzátoru. Přesná povaha a načasování posledních událostí není dobře pochopeno.

jak je znázorněno na energetickém diagramu, hydrogenace alkenů je exotermní a teplo se uvolňuje odpovídající ΔE (zelené barvě) v diagramu. Toto reakční teplo lze použít k posouzení termodynamické stability alkenů s různým počtem alkylových substituentů na dvojné vazby. Například následující tabulka uvádí zahřívání hydrogenace pro tři alkeny C5H10, které poskytují stejný alkanový produkt (2-methylbutan). Vzhledem k tomu, že velké reakční teplo naznačuje vysokoenergetický reaktant, jsou tato tepla nepřímo úměrná stabilitám alkenových izomerů. Na hrubou aproximací, vidíme, že každý alkyl substituent na dvojnou vazbu stabilizuje tato funkční skupina o trochu více než 1 kcal/mol.
| Alkene Isomer | (CH3)2CHCH=CH2 3-methyl-1-butene |
CH2=C(CH3)CH2CH3 2-methyl-1-butene |
(CH3)2C=CHCH3 2-methyl-2-butene |
|---|---|---|---|
| Heat of Reaction ( ΔHº ) |
–30.3 kcal/mole | –28.5 kcal/mole | –26.9 kcal/mole |

z zde uvedeného mechanismu bychom očekávali přidání vodíku se syn-stereoselektivitou. To je často pravda, ale hydrogenační katalyzátory mohou také způsobit izomeraci dvojné vazby před přidáním vodíku, v takovém případě může být stereoselektivita nejistá.

Cvičení
- V reakci
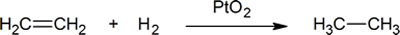
- 0.500 mol ethene reaguje s _______ mol vodíku. Chemik by tedy mohl říci, že ethen reaguje s jedním _______ vodíku.
- ethen je_______; zatímco _ _ _ _ _ _ _ je oxidován.
- oxidační číslo uhlíku v ethenu je _______; v etanu je_______.
- Při 1.000 g určitý triglyceridů (tuku) se smísí s vodíkem v přítomnosti Adamsův katalyzátor, je zjištěno, že objem plynného vodíku spotřebované na 99.8 kPa a 25.0°C je 162 mL. Samostatný experiment ukazuje, že molární hmotnost tuku je 914 g mol-1. Kolik dvojných vazeb uhlík-uhlík obsahuje sloučenina?
Odpovědi:
-
-
Zobrazit Odpověď
-
Zobrazit Odpověď
-
Zobrazit Odpověď
-
-
Zobrazit Odpověď
Examples
Question
Predict the products if the following alkenes were reacted with catalytic hydrogen.

Solution

Contributors
- Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
- Prof. Steven Farmer (Sonoma State University)
- organická chemie s biologickým důrazem Tim Soderberg (University of Minnesota, Morris)