kolik energie se uvolňuje při hydrolýze ATP?
režim čtečky
ATP je často označován jako energetická měna buňky. Stovky reakcí v buňce od metabolických transformací po signální události jsou spojeny s hydrolýzou (doslovně znamená „uvolnění vody“) ATP vodou . Reakce ATP + H2O <> ADP + Pi transformuje adenosin trifosfátu (ATP) na adenosindifosfát (ADP) a anorganický fosfát (Pi). Změna volné energie spojená s touto reakcí řídí velkou část buněčných reakcí, přičemž membránový potenciál a redukční výkon jsou dalšími dvěma dominantními zdroji energie. Ale přesně kolik stojí tato energetická měna a co odhaluje o chemických transakcích, které lze zakoupit? Samozřejmě, není tam žádná jediná odpověď na tuto otázku, protože množství energie uvolněné tímto hydrolýza reakce závisí na intracelulární podmínky, ale je možné, aby se získat pocit, pro přibližné „hodnotu“ této měny tím, že se uchylovat k nějaké jednoduché odhady.

Obrázek 1: vztah Gibbsova volná energie hydrolýzy ATP za standardních podmínek na rovnovážné konstanty a vztah pro volnou energii hydrolýzy za fyziologických podmínek na fyziologické koncentrace reaktantů.
Gibbs změna volné energie (ΔG), v důsledku hydrolýzy ATP závisí na koncentraci jednotlivých účastníků v reakci, jak je znázorněno na Obrázku 1. Když jsou koncentrace dále od jejich rovnovážných hodnot, absolutní hodnota ΔG je větší. Za „standardních“ podmínek (tj. koncentrace 1M pro všechny reaktanty kromě vody, která je přijata na jeho charakteristické koncentrace 55M) Gibbsova volná energie hydrolýzy ATP se pohybuje od -28 do -34 kJ/mol (tj. ≈12 kBT, BNID 101989) v závislosti na koncentraci kationtu Mg2+. Závislost na iontech Mg nastává, protože kladně nabité ionty hořčíku pomáhají stabilizovat molekulu ATP. V buňce se však podmínky nikdy nepřibližují standardním hodnotám stavu. Například koncentrace 1M ATP by znamenala, že hmotnost rozpuštěné látky by byla podobná hmotnosti samotného vodního rozpouštědla. Na obrázku 1 ukazujeme často matoucí odvození fyziologické volné energie (ΔG) vzhledem k poměru koncentrací od standardní hodnoty (ΔGo). Rozdělení podle termínů, které jsou vyžadovány pro péči o jednotky jako logaritmus, by mělo vždy obsahovat bezjednotkový termín. Někdy je překvapivé si myslet, že pokud by buňka byla v rovnováze, hodnota ΔG by byla nulová a hydrolýzou ATP by nebyla získána žádná energie. U živých organismů tomu tak naštěstí nikdy není. .
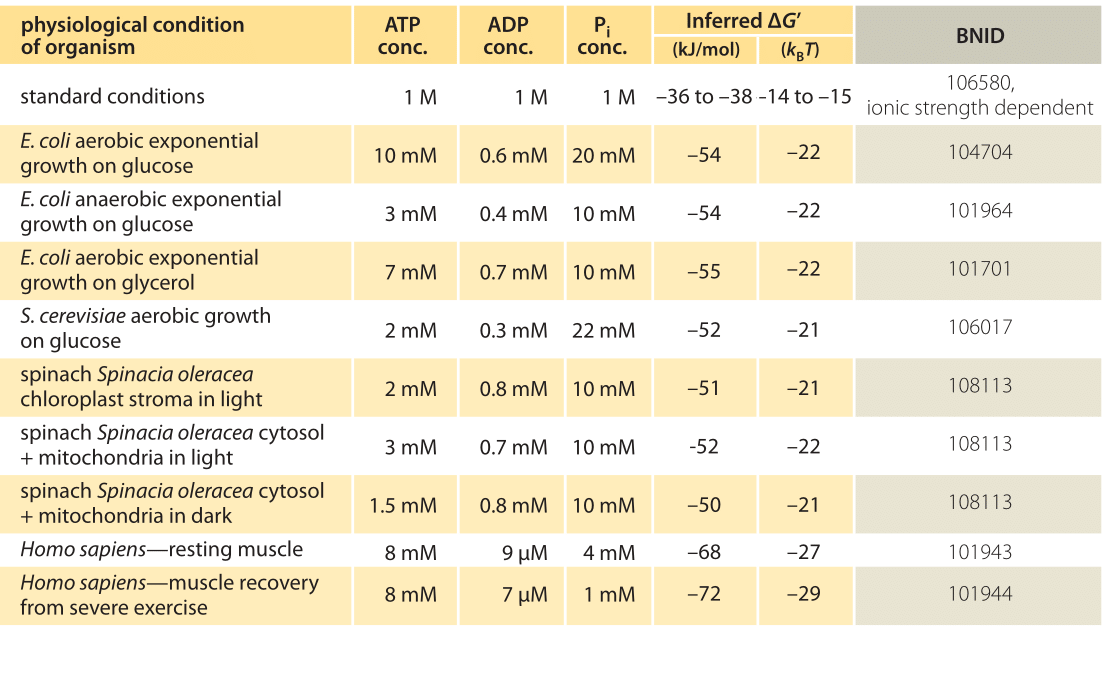
Tabulka 1: volná energie pro hydrolýzu ATP v různých organismech a za různých fyziologických podmínek. Odvozené výpočty ΔG ‚založené na hodnotě ΔG‘ 0 -37,6 kJ/ mol. To činí hodnoty tabulky konzistentní mezi sebou, ale vytváří malé odchylky od hodnot ΔG ‚ hlášených v primárních zdrojích. Takové odchylky mohou být důsledkem změn iontové síly, pH a metod měření. Hodnoty jsou zaokrouhleny na jednu nebo dvě významné číslice. Ve špenátu, kde koncentrace Pi nebyla hlášena, byla použita charakteristická hodnota 10 mM (BNID 103984, 103983 ,111358, 105540).
V praxi fyziologické podmínky jsou závislé na organismus studoval, tkáně nebo prostoru uvnitř buňky v úvahu, a na současné požadavky na energie pro metabolické a další reakce. Například, v perfundovaných játrech potkanů ATP na ADP poměr bylo zjištěno, že přibližně 10:1 v cytosolu, ale 1:10 v mitochondriích za vysoké sazby glykolýzy, a to za nízké ceny glykolýzy oba poměry byly moc blízko 1 (BNID 111357). Proto se očekává rozsah hodnot pro ΔG. Klíčem k pochopení tohoto rozsahu je získat představu o tom, kolik Q se liší od K, tj. jak se koncentrace liší od standardních podmínek. Typické intracelulární koncentrace všech relevantních složek (ATP, ADP a Pi) jsou v rozmezí mM, mnohem nižší než standardní podmínky. Poměr / s koncentracemi v rozmezí mM je mnohem nižší než jedna a reakce bude energeticky příznivější než při standardních podmínkách, jak je uvedeno v tabulce 1. Nejvyšší hodnota ≈-70 kJ/mol (≈30kBT) byla vypočtena z hodnot v lidském svalu sportovce zotavuje po námaze (BNID 101944). V buňkách E. coli rostoucích na glukóze byla hlášena hodnota -47 kJ / mol (≈20kBT, BNID 101964). Dát tato čísla do souvislostí, molekulární motor, který vyvine sílu zhruba 5 pN (BNID 101832) nad 10 nm (BNID 101857) velikost kroku dělá práci, aby 50 pN nm, což vyžaduje o něco více než 10 kBT energie, v rozsahu toho, co jeden ATP může přinést.
výpočty ΔG vyžadují přesné měření příslušných intracelulárních koncentrací. Tyto koncentrace se měří in vivo u lidí pomocí nukleární magnetické rezonance. Přirozená forma fosforu (31P) má magnetické vlastnosti, takže není třeba přidávat žádnou vnější látku. Tkáň zájmu, jako je sval, je umístěna v silném magnetickém poli a posuny frekvence rádiových impulzů se používají k odvození koncentrace ATP a Pi přímo z vrcholů v NMR spektrech. V E. coli, koncentrace ATP lze měřit příměji pomocí bioluminiscenčního testu ATP. Vzorek rostoucí bakterie odstraněny z kultury mohou být testovány pomocí luciferase, bílkoviny z bakterií, které žijí v symbióze s kalamáry, ale to se teď připojil toolbox biologů jako molekulární reportér. Enzym luciferázy používá ATP v reakci, která produkuje světlo, které lze měřit pomocí luminometru, a koncentraci ATP lze odvodit ze síly signálu. Máme tedy obsah buněk jako vstup, luciferázu jako „zařízení“, které transformuje množství ATP na emise světla, která slouží jako měřený výstup. Pomocí nástrojů, jako jsou tyto, člověk zjistí, že v „reálném životě“ ATP stojí asi dvakrát tolik jako za „standardních“ podmínek, protože koncentrace byly příznivější pro následující reakce.
skončíme konstatováním, že je to stojí otázka, proč adenin nukleotidů, byl vybrán, aby sloužil jako hlavní energetické měny s GTP a jiné nukleotidy slouží mnohem více menších rolí. Je to případ náhodného výběru, který se později stal „zmrazenou nehodou“, nebo existovala selektivní výhoda ATP oproti GTP, CTP, UTP a TTP?




