Určení některých parametrů, jako je velikost, délka a úhel v atomovém měřítku, není snadné. Vzhledem k důležitým z těchto parametrů, vědci vyvinuli metody odvodit nebo vypočítat parametry v atomové úrovni. Pořadí vazeb a délka vazby jsou dva takové důležité parametry, které označují typ a sílu vazeb mezi dvojicí atomů.
tento článek vysvětluje,
1. Co jsou pořadí vazeb a délka vazby
2. Jak Vypočítat Dluhopisů Pořadí a Délka Pouto
– Jak Vypočítat Dluhopisů, Aby
– Jak Vypočítat Délka Pouto
Jaké jsou Dluhopisů Pořadí a Délka Pouto
délka Pouto a vazba pořadí jsou dva parametry, které jsou spojeny s kovalentní vazby. Pořadí vazeb je počet chemických vazeb mezi dvěma atomy a délka vazby je vzdálenost mezi dvěma jádry atomů, které jsou kovalentně spojeny dohromady. Tento článek vysvětluje, jak vypočítat pořadí vazeb a délku vazby v atomové úrovni.
Jak vypočítat pořadí vazeb
pořadí vazeb je počet chemických vazeb mezi dvěma atomy. Označuje stabilitu vazby. V kovalentních vazbách je pořadí vazeb počet sdílených elektronů. Například pořadí vazeb dvojice atomů vázaných jednou vazbou je jedno, zatímco pořadí vazeb dvojice atomů Spojených dvojnou vazbou je dva. Pořadí nulové vazby znamená, že mezi atomy neexistuje žádná vazba. Stabilita molekuly se zvyšuje s rostoucím pořadím vazby. Molekuly s rezonanční vazbou nemusí být celé číslo. V kovalentní sloučeniny se dvěma atomy, vazebný řád mezi dvojice atomů, je dána první kreslení lewisových vzorců, a pak určení typu vazby mezi atomy – žádné pouto, single, double nebo triple bond. Například pořadí vazeb plynného vodíku se stanoví následovně.
- Kreslit lewisovy vzorce,
H: H
- Určit počet dluhopisů/pár valenčních elektronů
Jeden pár elektronů, tedy dluhopisů, cílem je 1.
Pokud existuje více než dva atomy, je pořadí vazby určeno následovně. Viz příklad: dusičnanový iont.
- Kreslit lewisovy vzorce
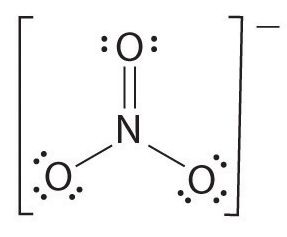
- celkový počet dluhopisů (podle dusičnanového iontu, 4)
- počet dluhopisů skupin mezi jednotlivými atomy (podle amoniaku, 3)
- Proto, bond order = Celkový počet dluhopisů: počet dluhopisů skupiny
= 4/3,
= 1.33
Proto, dluhopisů, aby dusičnanového iontu je 1.33
Jak Vypočítat Délka Pouto
Pouto délka je vzdálenost mezi dvěma jádry atomů, které jsou kovalentně spojeny dohromady. Délka vazby je obvykle v rozmezí 0,1 až 0,2 nm. Když jsou dva podobné atomy spojeny dohromady, polovina délky vazby se označuje jako kovalentní poloměr. Délka vazby závisí na počtu vázaných elektronů dvou atomů nebo pořadí vazby. Vyšší pořadí vazby, kratší délka vazby bude způsobena silnými tažnými silami kladně nabitých jader. Jednotkou délky vazby je pikometr. V jednolůžkových, dvoulůžkových a třílůžkových dluhopisů, dluhopisů délka se zvyšuje v pořadí
trojné vazby<dvojná vazba<jednoduchá vazba,
Elektronegativita může být použit pro výpočet délka pouto mezi dvěma atomy, které mají různé electronegativities. Následující empirický vzorec navrhl Shoemaker a Stevenson pro výpočet délky vazby.
dA-B = rA + rB – 0.09 (xA – xB)
dA-B je bond vzdálenost mezi dvěma atomy a a B, rA a rB jsou kovalentní poloměry a, B, a
(xA – xB) je electronegativity rozdíl mezi a a B.
Další metodou je použít pro výpočet přibližné délka pouto. V této metodě, první Lewisova struktura je nakreslena pro stanovení typu kovalentní vazby. Poté pomocí grafu * provedeného na studiích provedených Cordero et al. , a Pyykkö a Atsumi, jsou stanoveny odpovídající poloměry vazeb vytvořených každým atomem. Potom se délka vazby určí součtem dvou poloměrů. Například při určování délky vazby oxidu uhličitého je nakreslena první Lewisova struktura.
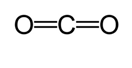
Podle grafu, kovalentní poloměr uhlíku dvojná vazba je 67 picometers a kyslík dvojná vazba je 57 picometers. Proto je délka vazby oxidu uhličitého přibližně 124 pikometrů (57 pm+ 67 pm).
* kovalentní graf se nachází zde
Reference:
Cordero, Beatriz, et al. „Kovalentní poloměry se znovu objevily.“Dalton Transakce 21 (2008): 2832-2838.
Libretexts. „Pořadí a délky dluhopisů.“Chemie LibreTexts. Libretexts, 05 Prosinec. 2016. Web. 10.ledna. 2017.
Lister, Ted, a Janet Renshaw. Porozumění chemii pro pokročilou úroveň. N. p.: Nelson Thornes, 2000. Tisek.
Pratiyogita Darpan. „Vlastnosti prvků ve vztahu k jejich elektronické struktuře .“Soutěž Science Vision Aug. 1998: n. pag. Tisek.
Pyykkö, Pekka a Michiko Atsumi. „Molekulární dvojné vazby kovalentní poloměry pro prvky Li-E112.“Chemistry-A European Journal 15.46 (2009): 12770-12779.
![]()