Pokud jste někdy studovali periodickou tabulku prvků (viz níže), pravděpodobně již víte, že tato tabulka odhaluje mnoho o chemických vlastnostech atomů, které tvoří náš svět.
Ale nesmíte si uvědomit, že každý čtverec v periodické tabulce ve skutečnosti představuje rodina izotopy — atomy, které mají stejný název a chemické vlastnosti, ale mají různé hmotnosti.
abychom pochopili, co jsou izotopy a jak je můžeme použít, musíme se blíže podívat na vnitřek atomu.

Stavební bloky hmoty
atom se skládá z neuvěřitelně husté jádro (jádro) z protonů a neutronů, obklopená difúzní oblak elektronů.
můžete Si protony a neutrony jako stejný druh částice s jedním klíčem rozdílem: protony jsou kladně nabité, zatímco neutrony nenesou žádný náboj. To znamená, že protony mohou „cítit“ elektrické nebo magnetické pole, zatímco neutrony nemohou.
elektrony, které jsou mnohem lehčí než protony nebo neutrony, nesou stejné velikosti náboje jako proton, ale s opačným znaménkem, což znamená, že každý atom má stejný počet protonů a elektronů je elektricky neutrální.
jsou to elektrony, které určují chemické chování určitého prvku.

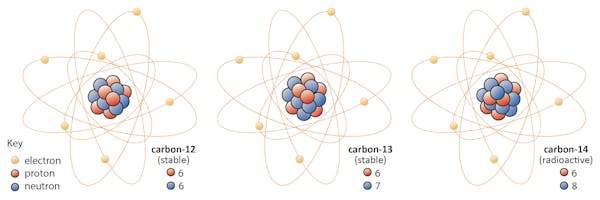
Izotopy prvku sdílet stejný počet protonů, ale různým počtem neutronů. Jako příklad použijeme uhlík.
V přírodě se nacházejí tři izotopy uhlíku-uhlík-12, uhlík-13 a uhlík-14. Všechny tři mají šest protonů, ale jejich neutronová čísla – 6, 7 a 8-se liší. To znamená, že všechny tři izotopy mají různé atomové hmotnosti (nejtěžší je uhlík-14), ale sdílejí stejné atomové číslo (Z=6).
chemicky jsou všechny tři nerozeznatelné, protože počet elektronů v každém z těchto tří izotopů je stejný.
takže různé izotopy stejného prvku jsou chemicky identické. Některé izotopy však mají schopnost obejít toto pravidlo tím, že se zcela transformují na jiný prvek.
Pochodovat směrem ke stabilitě
Tento transformační schopnost některé izotopy mají má co do činění s faktem, že ne všechny izotopy jsou stabilní, a je to, co vedlo Frederick Soddy, aby jeho nositel Nobelovy Ceny za objev izotopů v roce 1913.
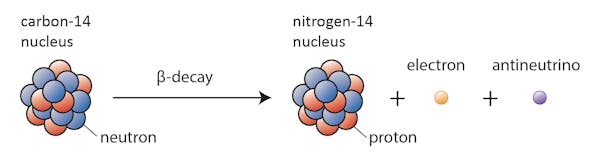
některé izotopy-například uhlík-12-budou šťastně existovat jako uhlík, pokud se nestane něco mimořádného. Ostatní-uhlík-14, říci – se v určitém okamžiku rozpadne na stabilní izotop poblíž.
v tomto případě se jeden z neutronů v uhlíku-14 změní na proton a vytvoří dusík-14. Během tohoto procesu, který je známý jako beta rozpad, jádro emituje záření ve formě elektronu a antineutrina.
existuje mnoho faktorů, které mohou způsobit rozpad jádra. Jedním z nejdůležitějších je poměr protonů k neutronům, které má konkrétní jádro. Pokud má jádro příliš mnoho neutronů (definice „příliš mnoho“ závisí na tom, jak těžké je jádro), existuje šance, že se rozpadne směrem ke stabilitě.
totéž platí, pokud má jádro příliš mnoho protonů. To je jeden z důvodů, proč jsou některé izotopy daného prvku radioaktivní, zatímco jiné nejsou.
z břicha hvězd
nyní se možná divíte, jak byly všechny tyto izotopy vytvořeny. Jak se ukazuje, tato otázka je složitá, ale propůjčuje určitou pravdu rčení, že jsme všichni stvořeni z hvězdného prachu.
některé lehčí izotopy byly vytvořeny velmi brzy v historii vesmíru, během Velkého třesku. Jiné jsou výsledkem procesů, které se dějí ve hvězdách nebo v důsledku náhodných kolizí mezi vysoce energetickými jádry-známými jako kosmické paprsky-v naší atmosféře.
většina přirozeně existujících izotopů je konečným (stabilním nebo dlouhodobým) produktem, který je výsledkem dlouhé řady jaderných reakcí a rozpadů.
Ve většině z těchto případů, lehkých jader, museli rozbít spolu s dostatkem energie, aby se silná síla – lepidlo-jako pouto, které se tvoří, když protony a neutrony dostat dost blízko na dotek – překonat elektromagnetické síly, které tlačí protony od sebe. Pokud silná síla zvítězí, srážející se jádra se spojí nebo se spojí a vytvoří těžší jádro.
naše Slunce je toho dobrým příkladem. Jedním z jeho hlavních zdrojů energie je řada fúzních reakcí a procesů rozpadu beta, které přeměňují vodík na helium.

Od počátku 1900s, když existenci izotopů byl poprvé uvědomil, jaderní fyzici a chemici hledají způsoby, jak studovat, jak izotopy mohou být vytvořeny, jak oni se rozkládají, a jak je můžeme používat.
Jak se ukázalo, příroda izotopů – jejich chemické jednotnost, své jaderné rozlišovací způsobilosti – je užitečné pro širokou škálu aplikací v tak různorodých oblastech, jako je medicína, archeologie, zemědělství, energie a hornictví.
Pokud jste někdy měli pet sken, měli jste prospěch z vedlejšího produktu radioaktivního rozpadu určitých izotopů (často nazývaných lékařské izotopy). Tyto lékařské izotopy vyrábíme na základě našich znalostí o tom, jak probíhají jaderné reakce, pomocí jaderných reaktorů nebo urychlovačů nazývaných cyklotrony.
ale také jsme našli způsoby, jak využít přirozeně se vyskytujících radioaktivních izotopů. Uhlík chodit s někým, například, využívá izotopový uhlík s dlouhou životností-14 určit, jak staré objekty jsou.
za normálních okolností je uhlík-14 produkován v naší atmosféře reakcí kosmického záření s dusíkem-14. To má poločas přibližně 5700 let, což znamená, že polovina množství uhlíku-14 bude mít shnilé pryč v té době.

Zatímco biologický organismus je živý, to trvá přibližně jeden uhlík-14 izotop pro každý bilionu stabilní uhlík-12 izotopů a uhlíku 12 na uhlík-14 poměr zůstává přibližně stejný, zatímco organismus žije. Jakmile zemře, nový příjem uhlíku se zastaví.
to znamená, že poměr uhlíku-14 k uhlíku-12 se mění v zbytcích tohoto organismu v průběhu času.
Pokud extrahujeme uhlík chemickými metodami ze vzorku, můžeme použít metodu zvanou urychlovač hmotnostní spektrometrie (AMS) k oddělení jednotlivých izotopů uhlíku podle hmotnosti.
AMS využívá skutečnosti, že urychlených částic se stejným nábojem, ale různé hmotnosti následovat samostatné cesty přes magnetické pole. Využitím těchto samostatných cest, můžeme určit izotopové poměry s neuvěřitelnou přesností.
jak můžete vidět z těchto příkladů, aplikujeme naše znalosti izotopů různými způsoby. Vyrábíme, odhalit, rozbalit, a jejich studium s dvojím účelem pochopení, proč atomové jádro se chová, jak to dělá, a jak můžeme využít jeho síly pro náš prospěch.