V jiných oddílech bylo zmíněno, že mnohé vlastnosti pevných látek, kapalin a plynů, by mohla být účtovány, pokud budeme předpokládat, že látky jsou tvořeny z atomů nebo molekul, které jsou neustále v pohybu. Boyleův zákon a další zákony plynu nyní nám dali mnohem více kvantitativní informace o plynech, a je třeba se ptát, zda s předchozím modelem, můžeme provést kvantitativní předpovědi ve shodě s těmito zákony. Při zodpovězení této otázky získáme také důležité poznatky o povaze teploty a tepelné energie.
mikroskopická teorie chování plynů založená na molekulárním pohybu se nazývá kinetická teorie plynů. Jeho základní postuláty jsou uvedeny v Tabulce 1:
TABULKA \(\PageIndex{1}\) Postuláty Kinetické Teorie Plynů.
1 molekuly v plynu jsou malé a velmi daleko od sebe. Většina objemu, který plyn zabírá, je prázdný prostor.
2 molekuly plynu jsou v konstantním náhodném pohybu. Stejně jako mnoho molekul se pohybuje v jednom směru jako v kterémkoli jiném.
3 molekuly se mohou srazit mezi sebou a se stěnami nádoby. Kolize se stěnami představují tlak plynu.
4, Kdy ke kolizím dochází, molekuly ztrácet kinetickou energii; to znamená, že srážky jsou dokonale pružné. Celková kinetická energie všech molekul zůstává konstantní, pokud tam je nějaký vnější zásah,
5 molekul vyvíjet žádné přitažlivé nebo odpudivé síly na jeden další až během procesu kolize. Mezi kolizemi se pohybují v přímých liniích.
Z nich je možné odvodit následující výraz pro tlak plynu z hlediska vlastnosti jeho molekuly.
\, Kde P, V = tlak a objem plynu
N = počet molekul
m = hmotnost každé molekuly
(u2)ave = průměr (nebo mysli) čtverců všech jednotlivých molekulárních rychlostí. Tato střední čtvercová rychlost musí být použita, protože tlak je úměrný čtverci molekulární rychlosti a molekulární srážky způsobují, že různé molekuly mají zcela odlišné rychlosti.
spíše než o sebe s postupem pro odvození Eq. \(\ref{1}\), podívejme se na rovnici a uvidíme, že její obecné rysy jsou tolik, kolik bychom očekávali. V některých ohledech je schopnost to udělat pomocí vzorce užitečnější než schopnost odvodit. Číslo \(\PageIndex{1}\)
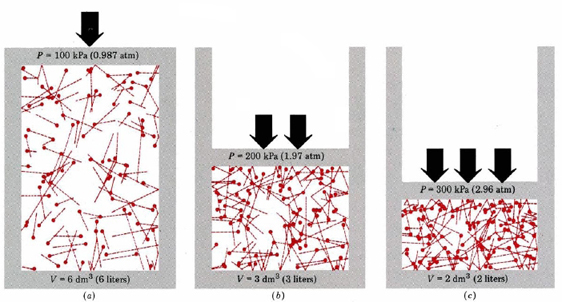 za Prvé, rovnice nám říká, že tlak plynu je přímo úměrná počtu molekul dělený objemem. To je graficky znázorněna na Obrázku \(\PageIndex{1}\), kde počítač má vypracován stejný počet molekul plynu zaujímá každý ze tří různých objemů. „Ocas“ na každé molekule ukazuje přesnou cestu následovanou touto molekulou v předchozí mikrosekundě – čím delší ocas, tím rychleji molekula šla. Průměr čtverců délek ocasu je úměrný (u2)ave a je stejný ve všech třech diagramech. Předpokládá se také, že všechny molekuly mají stejné hmotnosti.
za Prvé, rovnice nám říká, že tlak plynu je přímo úměrná počtu molekul dělený objemem. To je graficky znázorněna na Obrázku \(\PageIndex{1}\), kde počítač má vypracován stejný počet molekul plynu zaujímá každý ze tří různých objemů. „Ocas“ na každé molekule ukazuje přesnou cestu následovanou touto molekulou v předchozí mikrosekundě – čím delší ocas, tím rychleji molekula šla. Průměr čtverců délek ocasu je úměrný (u2)ave a je stejný ve všech třech diagramech. Předpokládá se také, že všechny molekuly mají stejné hmotnosti.
jak vidíte, snížení objemu plynu zvyšuje počet kolizí na jednotku plochy na stěnách nádoby. Každá kolize vyvíjí sílu na stěnu; síla na jednotku plochy je tlak, a tak počet kolizí na jednotku plochy je úměrný tlaku. Snížení objemu na polovinu zdvojnásobuje tlak, předpověď, která souhlasí s experimentálními fakty shrnutými v Boyleově zákoně. Rovnice \(\ref{1}\) také říká, že tlak je úměrný hmotnosti každé molekuly plynu. Znovu, to je to, co bychom očekávali. Těžké molekuly dávají větší „tlak“ (technický termín pro toto je impuls) proti zdi než lehké se stejnou rychlostí.
nakonec nám rovnice říká, že tlak je úměrný průměru čtverců molekulárních rychlostí. Tato závislost na čtverci rychlosti je rozumná, pokud si uvědomíme, že zdvojnásobení rychlosti molekuly má dva účinky.
nejprve se molekula může v dané době pohybovat dále a zdvojnásobit počet kolizí se stěnami. To by zdvojnásobilo tlak. Za druhé, zdvojnásobení rychlosti molekuly zdvojnásobí tlak nebo impuls každé kolize. To opět zdvojnásobuje tlak. Proto zdvojnásobení rychlosti molekuly čtyřnásobně zvyšuje tlak a pro velký počet molekul je P úměrné střední čtvercové rychlosti.
Přispěvatelé
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff, a Adam Hahn.